A la era moderna de la medicina en la que ens trobem, els antibiòtics han demostrat ser eines imprescindibles per salvar vides tractant aquelles infeccions que temps enrere eren letals. Desgraciadament, hi ha una amenaça silenciosa que podria acabar amb la sanitat tal com la coneixem: la resistència als antibiòtics (RAB). Fem servir aquest terme per descriure el fenomen en el que certs microorganismes es tornen immunes als medicaments utilitzats per combatre’ls. A mesura que la RAB augmenta, és crucial reconèixer la importància de l’ús responsable dels antibiòtics, seguir les dosis adequades i evitar l’automedicació per contribuir a la lluita contra aquesta crisi global.
I no n’estem fent un gra massa, els experts calculen que al voltant de 2050, les infeccions (les que abans tractàvem amb antibiòtics) podrien ser la primera causa de mort al món, per davant d’accidents, càncer o malalties del cor. I per si encara no us sentiu involucrats amb el problema, penseu que en aquest futur no tant llunyà tenir una ferida infectada, patir una infecció post-operatòria, o agafar una malaltia quan anem a veure un familiar a l’hospital es podrien tornar infeccions sense tractament!
Com pot ser que els bacteris evolucionin tant ràpid per adquirir resistències?
Molt senzill, a part que els bacteris es poden reproduir molt més ràpid que nosaltres (en algunes espècies, reproduïnt-se cada 20 minuts si tenen suficients nutrients!), l’ús descontrolat d’antibiòtics per part nostra està fomentant aquesta adquisició de RAB.
Saltar-se les dosis o aturar el tractament prematurament pot no eliminar completament els bacteris patògens, donant-los l’oportunitat de desenvolupar resistència. Això contribueix a la creació de “superbacteris”, soques de bacteris que poden suportar múltiples antibiòtics fins i tot combinats. Veiem un exemple:
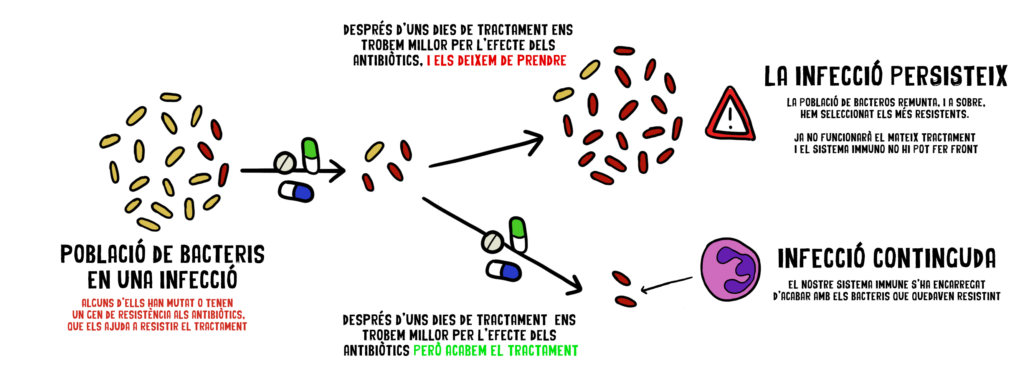
És crucial seguir acuradament les instruccions del metge i completar el curs complet d’antibiòtics, sobretot encara que comencem a sentir-nos millor. En un món on la informació està a un clic de distància, és temptador diagnosticar-nos i tractar-nos, però els antibiòtics són específics només per a certs tipus de bacteris, i utilitzar-los sense control és pràctica perillosa a llarg termini (per l’adquisició de RAB) però també a curt termini, perquè podem estar matant sense voler els bacteris beneficiosos que formen la nostra microbiota intestinal.
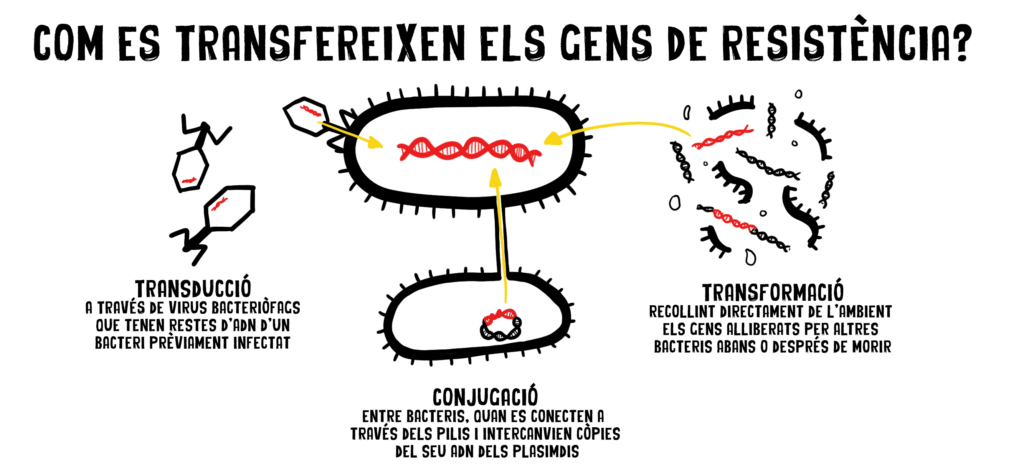
Per acabar-ho d’adobar, els bacteris tenen mecanismes per compartir entre ells els gens que els donen aquestes resistències, com si es tractés d’un joc de cartes col·leccionables! Ens referim a aquests mecanismes com a “elements mòbils genètics”, i els tres més importants que coneixem són la transducció, la conjugació i la transformació:
Tenim armes per fer front als bacteris resistents si ens quedem sense antibiòtics?
La resposta és sí, però aquestes armes no s’han estudiat encara suficientment per a ser desplegades a tota la població. El principal as a la màniga que ens queda per jugar són els bacteriòfags:
Els bacteriòfags, o “fags”, són virus dirigits a bacteris específics. Bàsicament, són els enemics naturals dels bacteris. Cada tipus de bacteriòfag només infecta a una variant molt específica d’un bacteri. Per tant, tenen potencial per servir d’assassins silenciosos i selectius, evitant la mort dels microorganismes que ens són beneficiosos. La teràpia amb bacteriòfags, que utilitza virus per tractar infeccions, és prometedora com a alternativa als antibiòtics, però també té mancances que cal superar. Alguns exemples són la necessitat d’identificar completament l’agent causal d’una infecció abans de poder procedir al tractament, la possibilitat de causar un xoc sèptic quan eliminen els bacteris en sang, o la possibilitat que els bacteriòfags puguin ajudar a transmetre gens de resistència entre bacteris sense acabar amb ells per complet.
Paral·lelament també s’estan estudiant els pèptids antimicrobians, que són proteïnes minúscules que produeixen alguns organismes, inclosos els humans, per combatre els microbis. Els investigadors estan explorant aquests pèptids com a alternatives als antibiòtics perquè actuen a través de mecanismes únics, pels quals adquirir una RAB és més difícil que amb els antibiòtics convencionals.
L’arma més forta: La conscienciació pública
Prevenir la propagació de la resistència als antibiòtics és un esforç global que requereix la col·laboració entre els proveïdors sanitaris, els responsables polítics, les indústries i el públic en general. Els governs i les organitzacions sanitàries estan implementant estratègies per regular l’ús d’antibiòtics tant en salut humana com animal. L’enfocament “Una sola salut” (impulsat per l’Organització Mundial de la Salut, l’Organització de les Nacions Unides per a l’Agricultura i Alimentació, i l’Organització Mundial de Sanitat Animal) reconeix la interconnexió de la salut humana, animal i ambiental, i és una estratègia crítica per gestionar aquesta crisi de manera eficaç.
La sensibilització és primordial en la lluita contra la resistència als antibiòtics. Com més en sapiguem, més equipats estarem per prendre decisions responsables. Educar-nos nosaltres mateixos i a les nostres comunitats sobre la importància d’utilitzar els antibiòtics amb prudència pot tenir un impacte substancial. Evitar l’automedicació, complir amb les dosis prescrites i utilitzar només antibiòtics quan els prescrigui un professional de la salut són passos senzills però potents que tots podem prendre!
Referències:
- Tang KWK, Millar BC, Moore JE. Antimicrobial Resistance (AMR). Br J Biomed Sci. 2023 Jun 28;80:11387. doi: 10.3389/bjbs.2023.11387.
- How resistance happens. Centers for Disease Control and Prevention (CDC). https://www.cdc.gov/drugresistance/about/how-resistance-happens.html
- Reina J, Reina N. Fagoterapia ¿una alternativa a la antibioticoterapia? [Phage therapy, an alternative to antibiotic therapy?)]. Rev Esp Quimioter. 2018 Apr;31(2):101-104. Epub 2018 Feb 16. PMID: 29451376




